[無料ダウンロード! √] 3重結合 電子式 290894
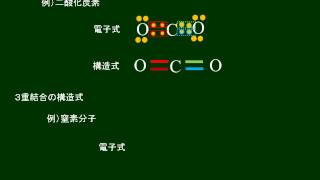
さんじゅうけつごう三重結合 triple bond 化合物の中の二つの原子が3個の共有結合で結ばれているとき,この結合を三重結合という。 構造式では3本の線で表して,とくに二つの炭素原子間の三重結合-C≡C-をアセチレン結合という。図2 ヘキサトリエンの構造式 CC 間距離:140pm(14˚A) CC 間結合角:1 ° π 電子軌道 L≈ 727pm 図3 ヘキサトリエンのπ電子雲 • アリス:え~っと、この絵を簡単に説明してくれるかしら。 • K氏:そうだね。 Hは水素を表しているのはいいよね。1個の電子を 最小エネルギー 状態に置く 1個の電子の状態 はそのままにして、 2個目の電子を 最小エネルギー 状態に置く ・ ・ ・ Zq q 他の電子q q Zq q Z eff q q 原子有効電荷!
高中化学 化学键必会知识点总结 离子
3重結合 電子式
3重結合 電子式-そして、窒素分子n 2 のように、価電子を3個ずつ出し合ってできる結合を、三重結合という。 9.構造式 分子を表す際、共有電子対を価標という線(-)で示した化学式を構造式という。 10.原子価 構造式において、それぞれの原子から出る価標の数を原子価という。原子価は、その原子がもつ不対電子の数に相当する。H‒Br の結合電子は Br 上のローンペアになる CC H3C H CH3 H H Br H‒Br 結合の2個の電子を Br が受け入れてローンペアにする =価電子が1個増える =マイナスの形式電荷 21



黑道圣徒3 重制版 Ign 评测7 分 画面不够玩法来凑 黑道圣徒3资讯 篝火营地
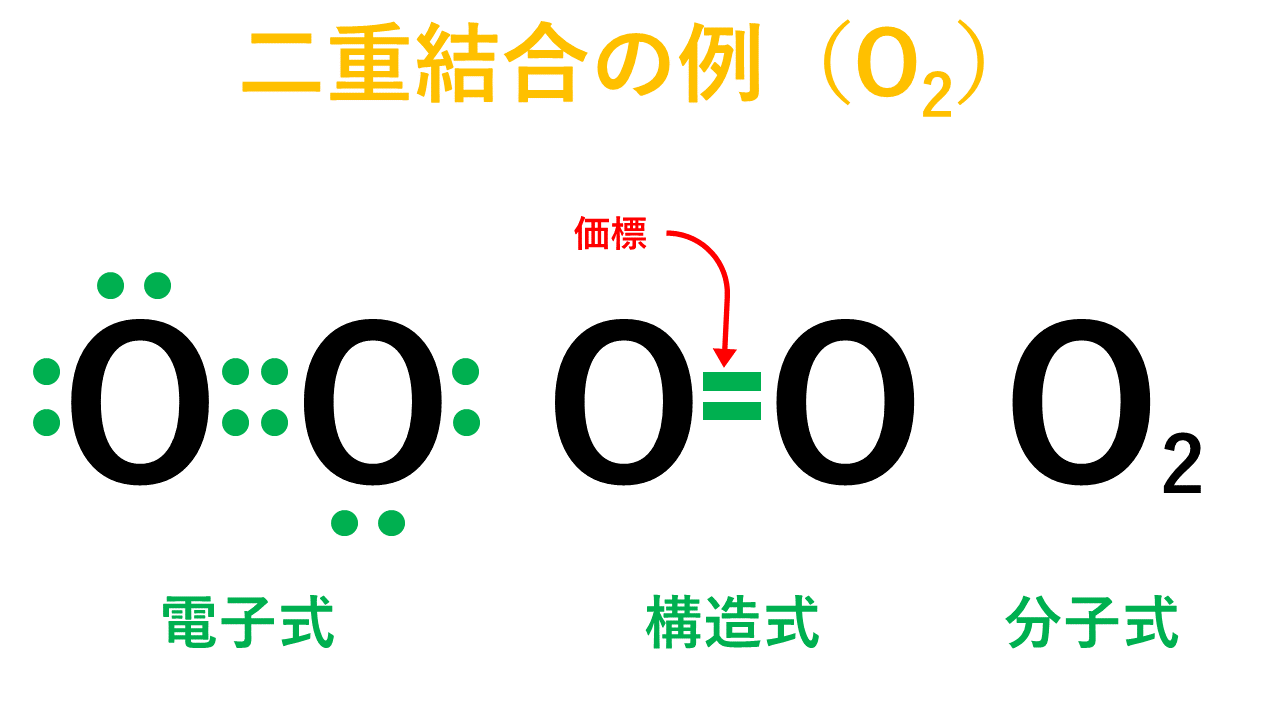
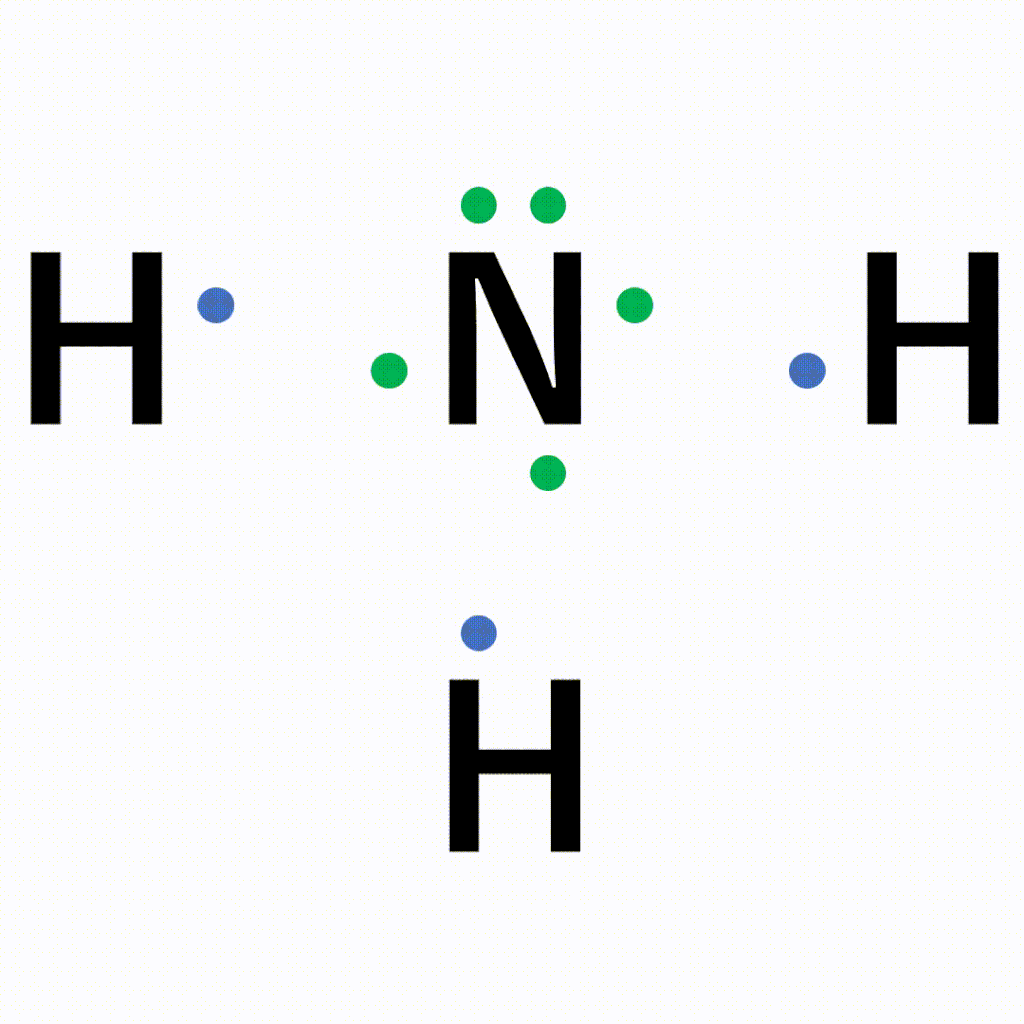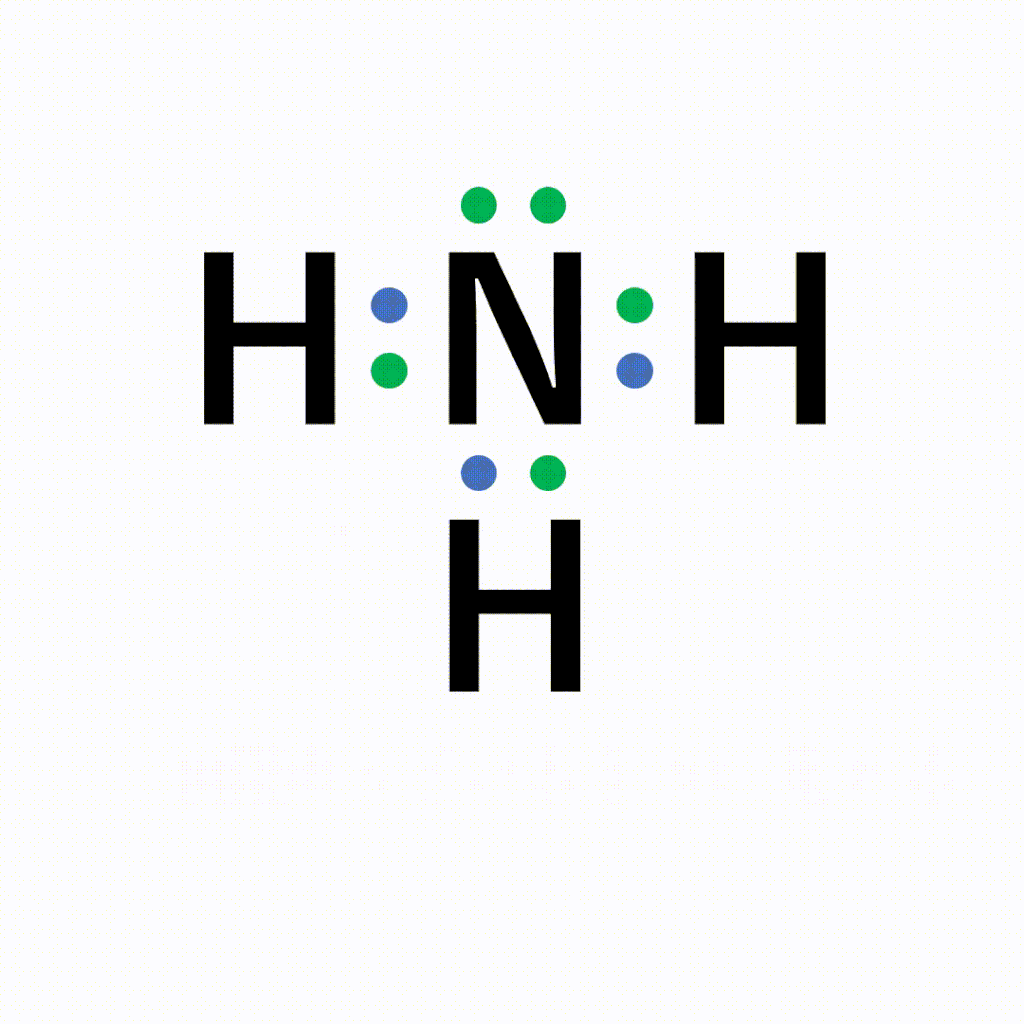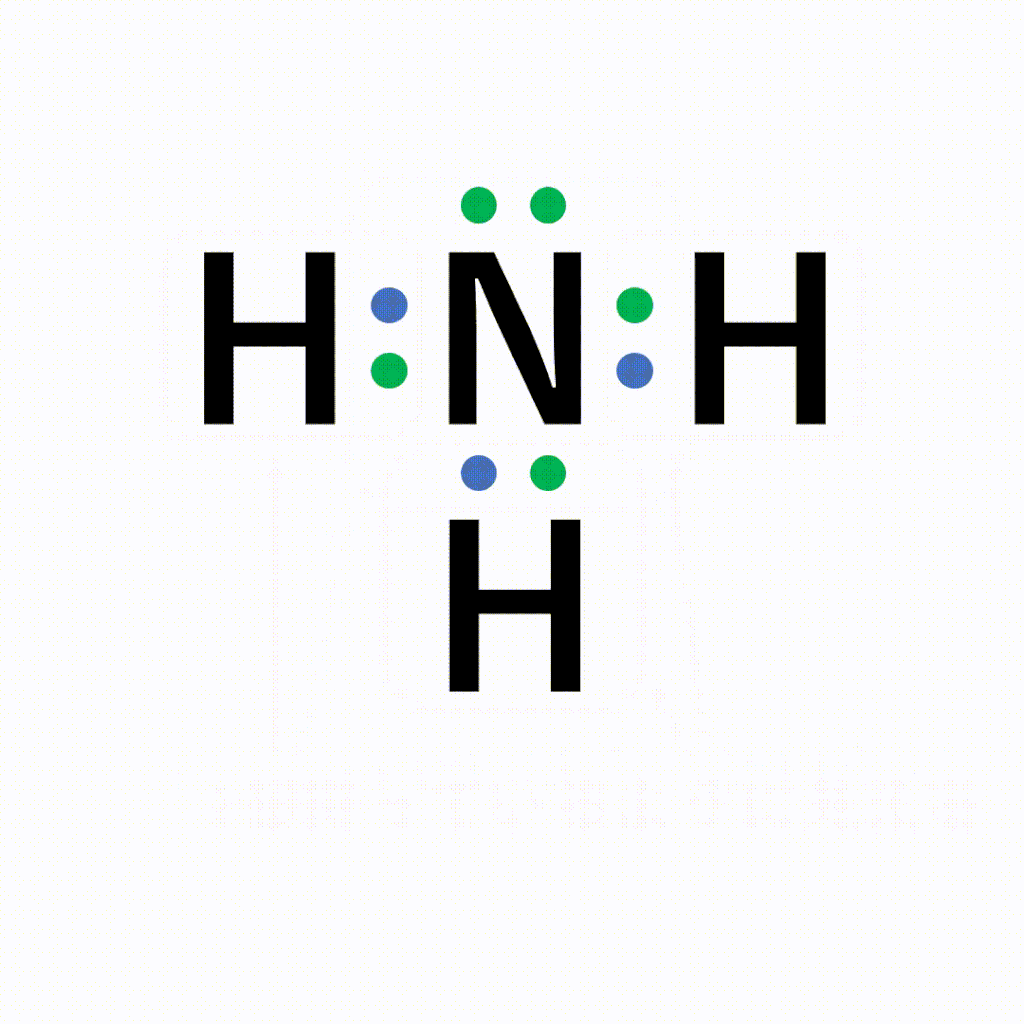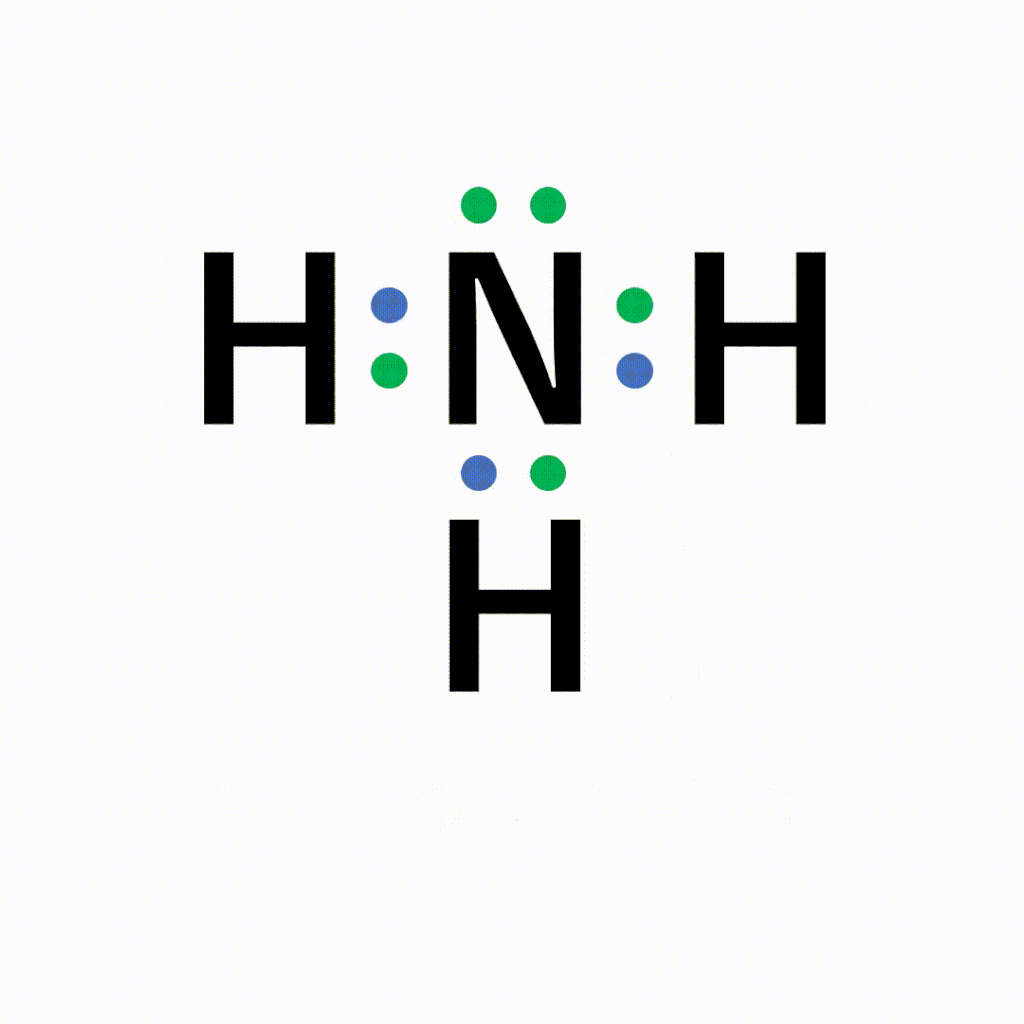
単結合 :1組の共有電子対による共有結合(例:水素分子H 2 ) 二重結合 :2組の共有電子対による共有結合(例:酸素分子O 2 ) 三重結合 :3組の共有電子対による共有結合(例:窒このようにして、 2ペア(4個)の電子からなる結合 を、 「二重結合」 といいます。 できる物質は、CO 2 (二酸化炭素)ですね。 3ペア(6個)の電子からなる「三重結合」3 分子と共有結合 不対電子と共有結合 電子式 最外殻電子を「・」で元素記号のまわり(上下左右)に添付した式を電子式という。電子は 2 個で対をつくり,対になったものを電子対という。
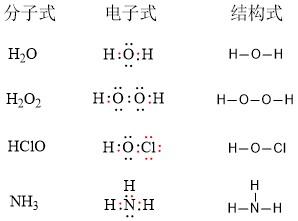
3-2 化学式(分子式・構造式・電子式)について 陽イオンと陰イオンは静電気的引力(クーロン力)で結合し、イオン結晶をつくる。 しかし陰イオンになる傾向の非金属は、電子を共有する形で安定な電子配置をとなる分子を作る。基礎化学4 電子不足結合 B H H B H H B H ジボラン(B2 6)の構造と分子軌道 3中心2電子結合(電子不足結合) B H H H B H H D2h b * a g * 177Å 133Å H Å H H B H H B H H H H 3g b 2g 119 from 2H B H H B H H B H B H B H H B H H B H H B H H b 1u b 2g a b 3u sp3 3 B H H B H H sp3 B H H 1s H (AO) b 3u a g g B H H B H H「核エネルギーの源泉」 上の (5) 式で表される 2個の重陽子の融合の 場合を考えましょう. 重陽子の結合エネルギーの 実験値は 約 MeV ですから 融合する前の2個の重陽子の 結合エネルギーの 合計は 約 4449 MeV です. 一方, の結合エネルギーの実験値は 約 7719 MeV です.
それが3つ出しあうから三重結合になる。 5個から3個ずつ出すから、自分の2個は残しておく(これが非共有電子対。 配位結合とかに使用する)。 質問者さんの画像の電子式だとnとnが電子を1個ずつ出しあうことになりますが、これってお互いにくっついてメリットあると思いますか?わかるだろう。反応はこのまま進行して、Br原子は2つの炭素原子と同時に結合を作 る。反応式で書くと、下のようになる。 H CC H 3C H H CH 3 Br2 CC HC H H CH Br Br アルケンのπ電子との反発で Br‒Br結合が分極する C C 3 CH HCH3 BrBr δδ– C C H3 H H H3C Br Br– cyclic だって構造式やら、電子式やらは、 二重結合って日本の結合がある というイメージですよね。 でも実際は、 このような画像になっています。 おそらく、学校とかで、 見せてもらった人も居るかもしれません、 意味不明ですよね。 この結合について、




化学基礎 電子式 その5 三重結合 Youtube



化学基礎 構造式 その2 二重結合と三重結合 Youtube
Sp 3 混成では分子の結合角が1095°、sp 2 混成軌道では結合角が1°、sp混成軌道では結合角が180°となっている。 電子は-(マイナス)の電荷を帯びており、お互いに反発する。そのため、それぞれの電子対は最も離れた位置に行こうとする。ブリタニカ国際大百科事典 小項目事典 共役二重結合の用語解説 炭素原子鎖が単結合と二重結合を交互に有するとき,この二重結合を共役二重結合という。最も簡単な例が2個の二重結合をもつ共役ジエン。その二重結合は非共役系化合物と異なった物理化学的性質を示す。16 共役π 電子系~単純 Hückel 法~ 分子軌道法の簡単かつきわめて有用な応用に,共役 電子系に対する Hückel 法がある。 共役 電子系とは,一重結合と二重結合が交互に現れるような系である。 (副読本 pp 142~162)



アニメーション解説 共有結合とは 二酸化炭素などの例を図で完全解説 サイエンスストック 高校化学をアニメーションで理解する




H2的电子式怎么写
ルイス式の考え方(1) 基礎化学4 全ての最外殻電子は対(電子対)を作ろうとする 結合電子対(bonding pair electron) 注)不対電子が存在する 場合もあるので注意する ABABA B 一重結合 single bond 二重結合 double bond 三重結合 triple bond 孤立電子対(lone Pair Electron) A問1 図355より導かれる一酸化炭素の結合次数はいくらか 計算式とともに示せ. 問2 電子配置から,一酸化炭素に電子を一つ加えたcoの 安定性を論ぜよ.また,coの結合次数を計算式とともに 示せ. 問3 基底状態の一酸化炭素は磁性を持つか,持たないか,構造式および分子式:アセチレン 教育: アセチレンの構造の特徴は、その特性、製造および用途に影響を及ぼす。 物質 Cの従来の指定 2 H 2 その最も単純で肉眼的な式です。 アセチレンは2つの炭素原子によって形成され、その間に三重結合が存在する



Http Www Mingdao Edu Tw Physics Pdf Matter 02 Pdf



Taic武華插件
③:電子対が動ける範囲は所属している原子のまわりだけ! ④:動かすのは2重結合!1重結合が動くと結合が切れてしまうのでダメ! 左端の炭素に着目すると、炭素のまわりには全部で8個の赤でしめした電子(4つの電子対)があることが分 かります。・電子の挙動は量子力学に従う ・原子中の電子は「原子軌道」に入っている ・原子軌道は「殻」に分かれている K殻:1s軌道 L殻:2s軌道、2p軌道(3個) M殻:3s軌道、3p軌道(3個)、3d軌道(5個) ・一つの原子軌道には電子が2個まで入ることができる 2 原子だけではなく、原子同士が共有結合してできた"分子"についても電子式で表すことができる。 分子の電子式に含まれる電子対のうち、2つの原子が電子を1コずつ出し合うことで形成される電子対を1、1つの原子がもつ電子のみで形成される電子対を2という。 問3解答/解説:タップで表示 解答:1共有電子対2非共有電子対 原子だけ



高中化学 化学键必会知识点总结 离子




圣剑传说3重制版中文版下载圣剑传说3重制版中文版单机游戏下载 玩游戏网
・1,3ジエンの共鳴構造式では真ん中に二重結合が存在する極限構造式が二つ描けることに なっています。実際にはこれらの構造の寄与は真ん中の構造の寄与と比べて小さいと 考えるべきでしょうか。 ・共役ジエンの立体配座に関して。1重項:電子ペアによって原子同士がお互いに結合している分子 ラジカル(2重項分子):ペアをつくっている電子の1個がとれた状態 3重項:1分子にペアになっていない電子を2個持つ分子 酸素は3重項(バイラジカル)で最も安定で反応性が低い前駆体として採用した(式1)3)。 (1) 1 アラインの遷移金属触媒反応4) 遷移金属触媒を用いて低活性な金属反応剤σ結合を 活性化し,炭素炭素多重結合へ付加させる反応は,多 様な金属元素を炭素炭素多重結合へ位置および立体選



Measurement Of Time Varying Electron Density Of Air Spark Shock Wave Plasma Jet By The Method Of Microwave Rayleigh Scattering



高中化学a14 化学键与分子间作用力 知乎
3の非共有電子対(sp3混成軌道)の 両方の電子がHイオン(電子なし)の 1s軌道に入り、化学結合が形成される。 NH 3 HNH=1073° 三角錐形 両原子が共有する2個の電子がすべてN原子から供与される受け入れる能力がある。酸素分子はこのように反結合性 MOに 電子を持っているため,そ の結合エネルギー (118kcal)は 一般の二重結合よりずっと低く,一 重結合 エネルギーにむしろ近い。 O2の 結合がこのように弱く,しかも有機物酸化の最終C=o結合の和と比較 するべき. (3)4個の分子軌道φnとその軌道エネルギーeは次の通りである. 各原子の電子密度と各結合の結合次数を求めよ. 0771 1034 0667 1529 0862 0495 0758 1.結合次数 c2とc3の間の結合次数p23は050である.




推薦十大電子料理磅秤人氣排行榜 21年最新版 Mybest




化学基礎です 電子式で 単結合だけ 共有電子対が縦に並んでいるのが 化学 教えて Goo
例:窒素(価電子5つ)は通常結合3本非共有電子対1つ n(価電子4つ,cと同じ)なら,結合を4本作れる. n-(価電子6つ,oと同じ)なら,結合2本と非共有 電子対2つになる. イオンにして,結合の本数を変えることも出来る アンモニウムイオン アジ化物\ \ x y zC8H4O3 Yes 1000g 6751mmol 1000g C6H6O2 No 743g 6751mmol 743g H2O4S 9807 No 662g 6751mmol 662g BH3O3 61 No 417g 6751mmol 417g C14H8O4 1622g 6751mmol 10g 8700% 1044g 4346mmol 6437% 構造式作図のTips 物性推算 反応式作図のTipsと量論表 SciFinderへの検索




電子式 構造式 Chemihack おうちで学べる化学




電子秤 磅秤 電子天平 電子台秤 計重秤 計數秤 吊秤 電子磅秤 地磅 砝碼 維修 校正 電子秤 地磅精傑實業有限公司
化学 における 三重結合 (さんじゅうけつごう、 英 triple bond )は、通常の単結合での2つの 電子 の代わりに6つの結合電子が関与する、2 元素 間の 化学結合 である。 最も一般的な三重結合は、 炭素炭素 間の結合であり、 アルキン で見ることができる。多重結合の特徴について,炭素数 2個と水素で構成される炭化水素(エタン,エチレン,アセチレン)を例に紹介する。 エタン( C 2 H 6 )は,sp 3 混成軌道の炭素原子による単結合の分子, エチレン(エテン: C 2 H 4 )は,sp 2 混成軌道の炭素原子による二重結合の分子,3 電子の軌道と波動関数 共有結合 シュレジンガー波動方程式 波動関数Ψ(x、y、z)はx、y、z の関数 (一つの電子についての関数として考える場合) s 軌道 p x、p y、p z 軌道 d z 2、d xy 2、d xz、d xy、d yz 軌道 軌道のエネルギーと構成原理 0 エ U m H E H 2 2 2!




澎坊免稅商店 19暢遊澎湖必備優惠護照 哪裡拿的到 來 電子護照傳送門 Facebook



方向盘下的玄机 详解可变转向系统 底盘电子 电子工程世界网
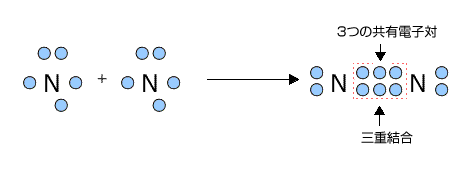
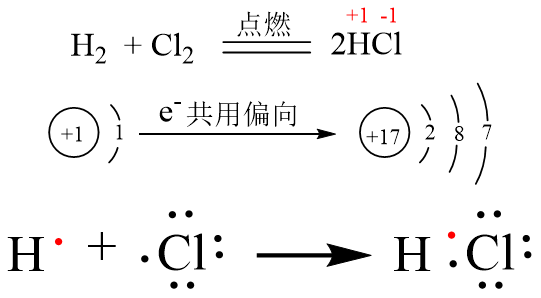
構造式: 共有電子対を価標(bond :線の数で単結合,二重結合,三重結合を表現する)で表示する。 電子式 (ルイス構造式): ラジカル反応などの化学反応での電子のやり取りなどを特に示したい場合などに,共有電子対を コロン (単結合 :,二重結合 ,三重結合 )で表示する。電子の全波動関数を により表わす エネルギー期待値 を最小化するように、係数u1, u2 を選ぶ(変分原理) 永年方程式 を解く 今の場合 H 全系のハミルトニアン ε S s軌道のエネルギー エネルギーの解は2個 共有エネルギー 結合状態 反結合状態反結合状態 ψ=u1ψ1 u2ψ2 ψψ 電子式で三重結合についてですが、 :N:: N: ・・ ↑ ココについてですが、H・+H・はH:Hですよね? では、三重結合の場合、どのような書き方になってるのでしょうか?




第二届国产嵌入式操作系统技术与产业发展论坛最新议程新鲜出炉 面包板社区



19年式 Mercedes Benz E Class 售價揭露amg車系追加e 53 E 63 S車型 國王車訊kingautos
「結合性軌道の電子の数-反結合性軌道の電子の数」 が重要になる. この差し引きの結果,結合性軌道に入っている電子の方が 2個多ければ単結合,4個多ければ二重結合,6個多けれ ば三重結合になる. (差し引きした結果が奇数なら,05重結合や15重結合と 2重結合の co は、 c は結合数2なので計算式(4-2-2=0)から電荷なし、 o も原子価通りで電荷なし。3重結合の co は、結合数の1つ多い o は+、 c の結合数は一つ少なく、孤立電子対を構造式 単結合・二重結合・三重結合 構造式の書き方 構造式を電子式に戻す方法 共有結合を図的に示す構造式とその書き方を紹介します。 構造式は後々になりますが有機化学を学ぶときに非常に役に立ちます。 分子の中で原子のつながり方を示すのでどういう仕組みで分子ができているか、どのような働きをもつ構造なのかが分かるようになりますよ。




この電子式で Cとnが三重結合するってどうやったらわかるんですか 暗記ですか Clear



高中化学 化学键必会知识点总结 离子




快速设置指南 Adobe Sign



Otda Ny Gov Programs Applications 46a Ch Pdf



アニメーション解説 共有結合とは 二酸化炭素などの例を図で完全解説 サイエンスストック 高校化学をアニメーションで理解する



化学講座 第6回 金属と非金属 化学結合 共有結合 医学部受験を決めたら 私立 国公立大学医学部に入ろう ドットコム
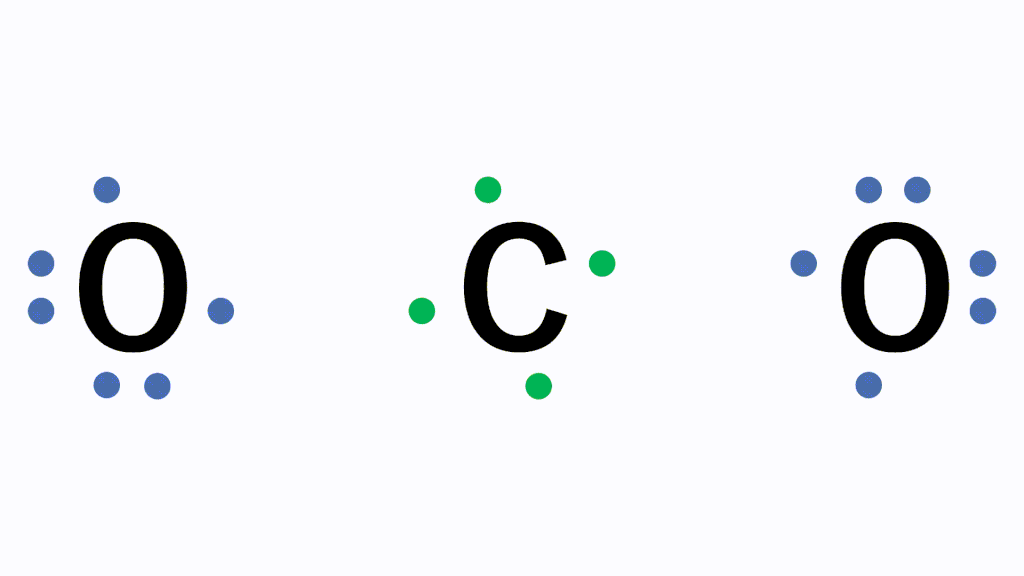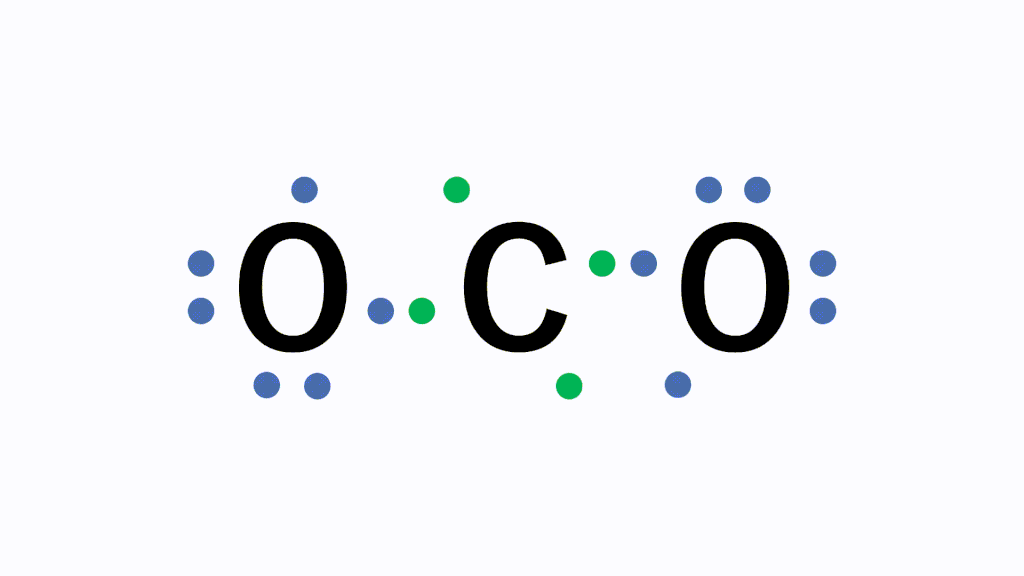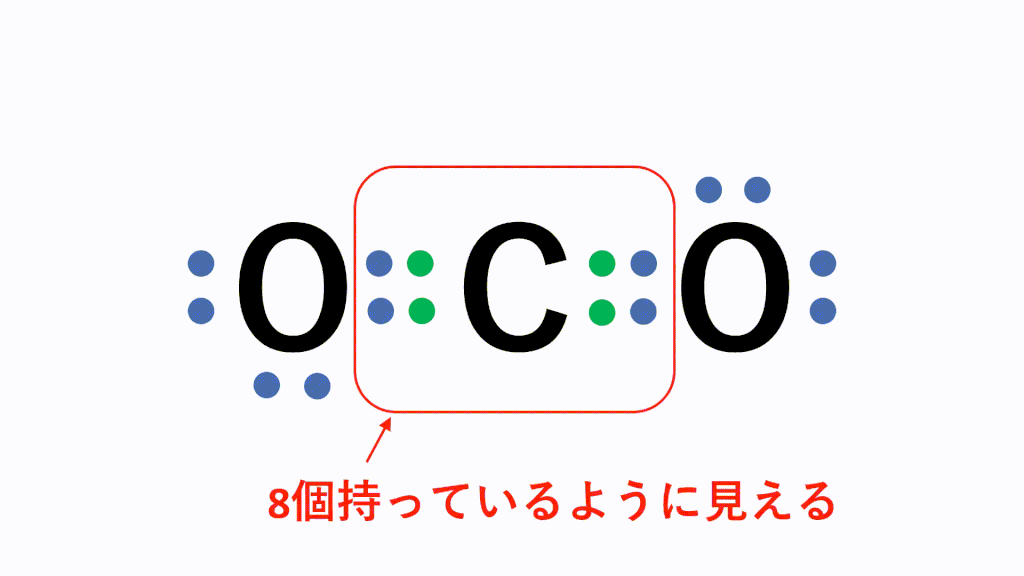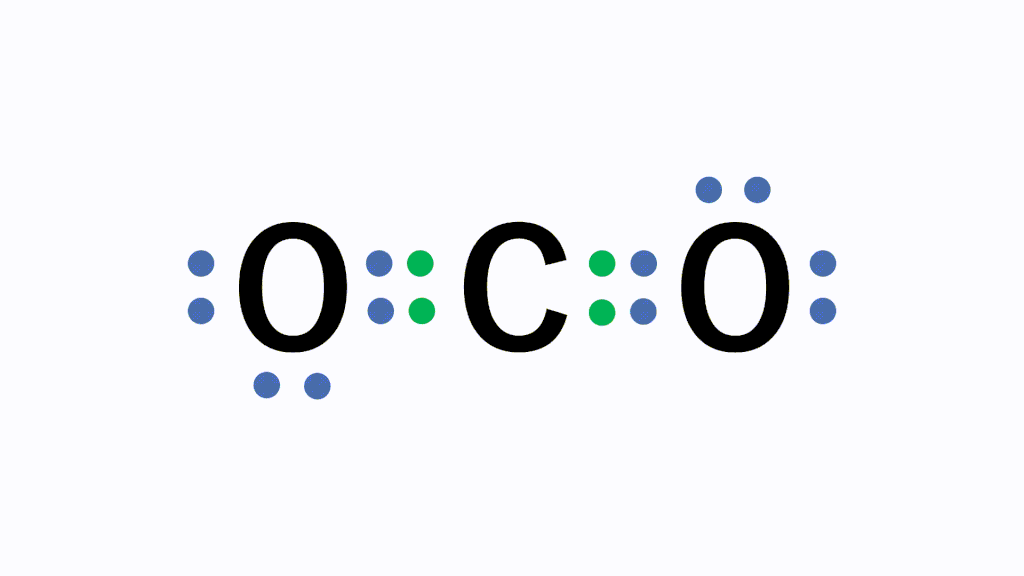



アニメーション解説 共有結合とは 二酸化炭素などの例を図で完全解説 サイエンスストック 高校化学をアニメーションで理解する



Cpr Heart Org Media Cpr Files Cpr Guidelines Files Highlights Hghlghts eccguidelines Chinese Traditional Pdf



黑道圣徒3 重制版 Ign 评测7 分 画面不够玩法来凑 黑道圣徒3资讯 篝火营地



Www Epa Gov Sites Production Files 05 Documents 0500 Traditional Pdf Peg Cht Pdf




化学基礎です 電子式で 単結合だけ 共有電子対が縦に並んでいるのが 化学 教えて Goo



Sony Ier Z1r 旗艦入耳式立體聲耳機廠商直送現貨 蝦皮購物




品牌 Adonit Pchome 24h購物




全台最大溜滑梯公園 新北三重熊猴森樂園全攻略 百種設施 30多座溜滑梯任你玩 捷運三重站出站就到



產品 Ferri Embedded Storage Silicon Motion




三重 丼飯 炸雞專賣店 日式台式泰式通通有 最便宜只要109元起 倫敦奶奶丼炸雞 Irene S 食旅 時旅




电子技术在冰箱压缩机启动控制系统中的应用 冰箱 启动 电子技术 新浪科技 新浪网



暗黑破壞神 Ii 獄火重生



Nの三重結合について 電子式の書き方はどちらが正しいですか Yahoo 知恵袋



闪存 维基百科 自由的百科全书



高中化学 化学键必会知识点总结 离子




电视 维基百科 自由的百科全书




なぜ窒素n2は三重結合なんですか 写真のように単結合はできないんですか Clear




School Year Program List Sf Department Of Children Youth And Their Families



Ex80 Getac




化学基礎 電子式 その4 二重結合 Youtube



轨道衡 静态轨道衡制造商 静态轨道衡价格 静态轨道衡生产基地 山东泰山衡器有限公司



H2的电子式怎么写



巫師3 狂獵 前中後期最強攻略



Efmdglobal Org Wp Content Uploads Sustainalble Business Tc Book Pdf



數位專業營養調理機3匹馬力 方杯 1 折扣 痞客邦



3




10個你該知道的吉他週邊配件 吉他好朋友




共價鍵 配位共價鍵單鍵 雙鍵或參鍵共價分子中電子對的分類分子化合物的特性 Ppt Download



Www Railway Gov Tw Tra Tip Web Tip File 4797f6bb 98d0 4bc9 81 Cb7b




算電費不必等兩個月智慧電表搭配台灣電力app 每6小時用電報你知 環境資訊中心



2




Js 淇譽電子 Jy3054 三件式喇叭 光華商場網路商城




台北通數位通行證上路環南3市場刷卡入場 地方 中央社cna




三藩市公立圖書館主頁 San Francisco Public Library



黑道圣徒3 重制版 Ign 评测7 分 画面不够玩法来凑 黑道圣徒3资讯 篝火营地



シアン化水素の電子式について 写真の三重結合の部分で 上 Yahoo 知恵袋
.jpeg)



售價95 9 萬起 新增2 0 Adventure 與電子後視鏡 21 年式toyota Rav4 發表 Carstuff 人車事



Measurement Of Time Varying Electron Density Of Air Spark Shock Wave Plasma Jet By The Method Of Microwave Rayleigh Scattering



Q Tbn And9gcqmwsdrpbdqo41j7togl Yvcm Pesmyambmzbc9erxoit6 Q2xo Usqp Cau




The New Actros 裕益汽車股份有限公司 台灣賓士授權重型商用車經銷商




三星奧德賽odyssey Neo G9揭開電競新紀元全球早鳥預購29日正式開跑台灣首波預購豪禮價值3萬起 Samsung Newsroom 台灣




电子技术在冰箱压缩机启动控制系统中的应用 冰箱 启动 电子技术 新浪科技 新浪网




三重 三重家樂福重劃區早餐 早餐結合手搖飲 一次擁有 Who S Tea Mini 集智店 Irene S 食旅 時旅



總文書 轉知新北市政府稅捐稽徵處為鼓勵民眾使用行動支付 電子支付或線上查繳稅等e化方式繳稅 特舉辦 新北e化繳稅抽好禮 抽獎活動 歡迎踴躍參加



產品 Ferri Embedded Storage Silicon Motion



2



1




Toyota Taiwan
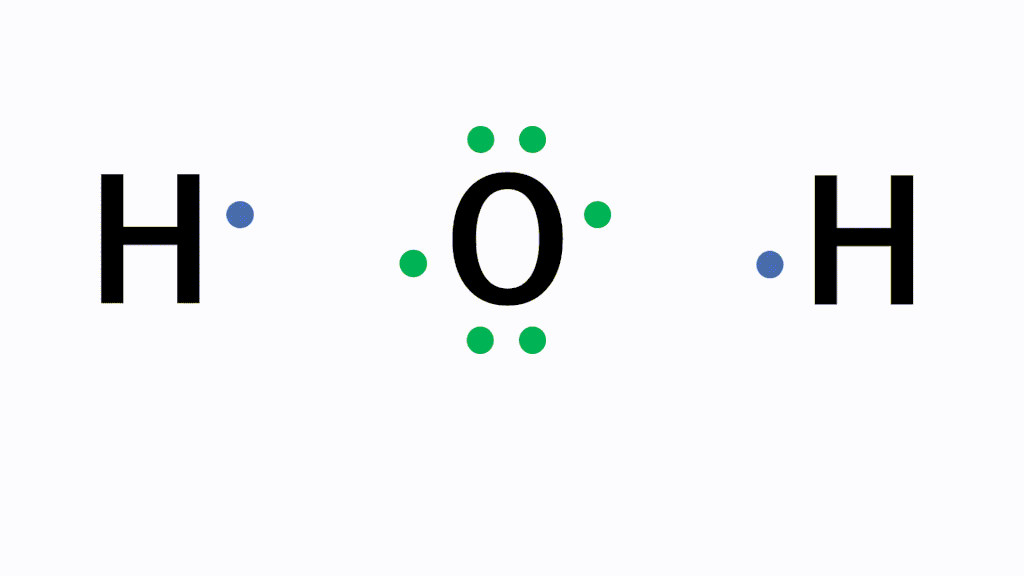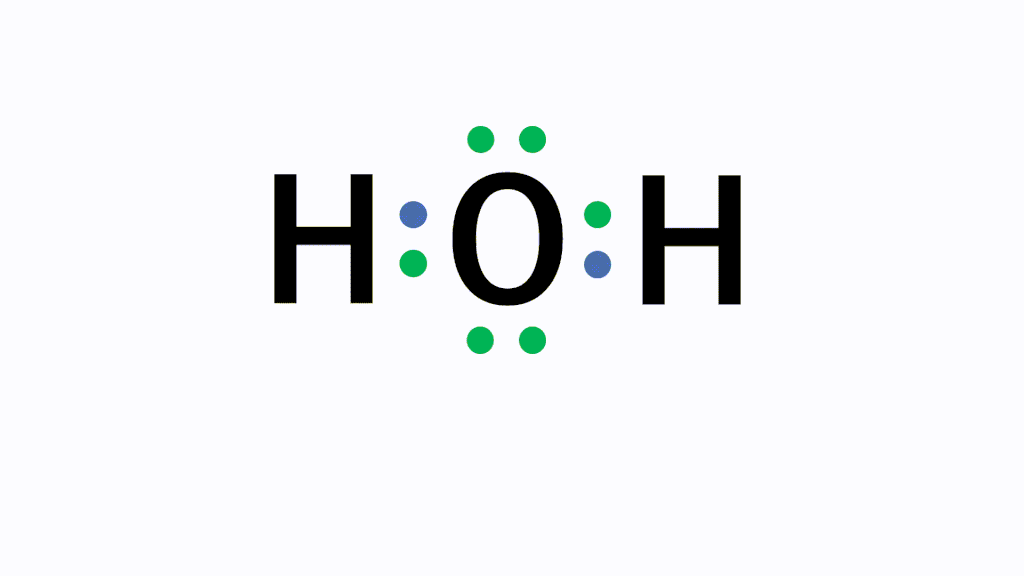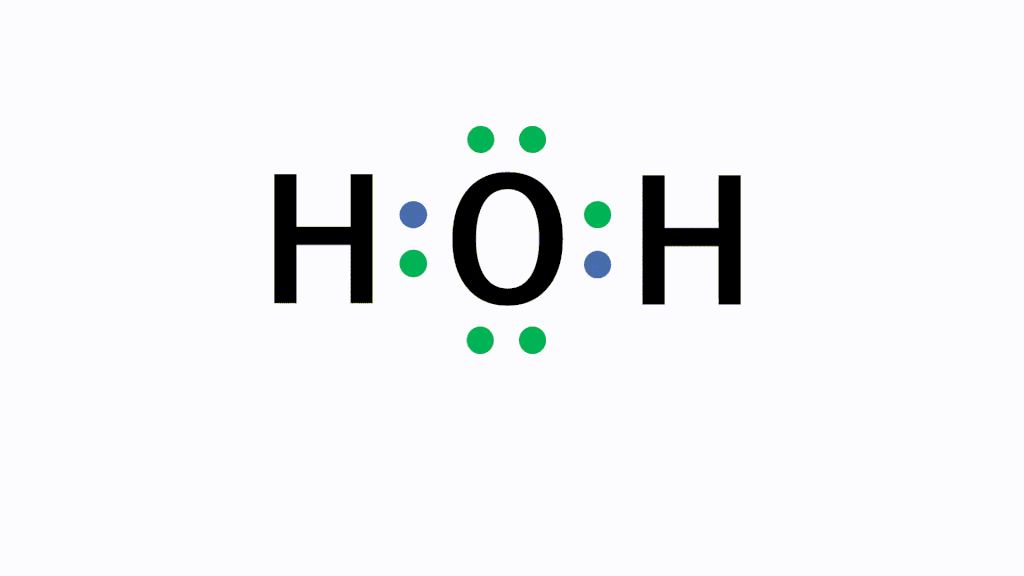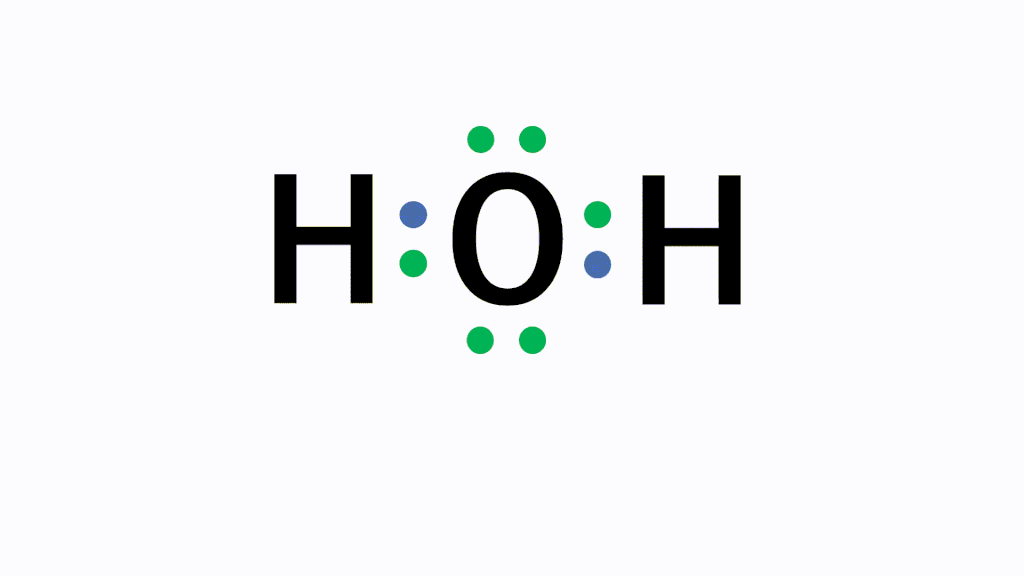



アニメーション解説 共有結合とは 二酸化炭素などの例を図で完全解説 サイエンスストック 高校化学をアニメーションで理解する




三重食記 北港龍門生炒鴨肉焿30年在地美食小吃 鋼管輸送好吃又特別 周花花 甲飽沒




高校化学基礎 電子式の書き方 映像授業のtry It トライイット



2
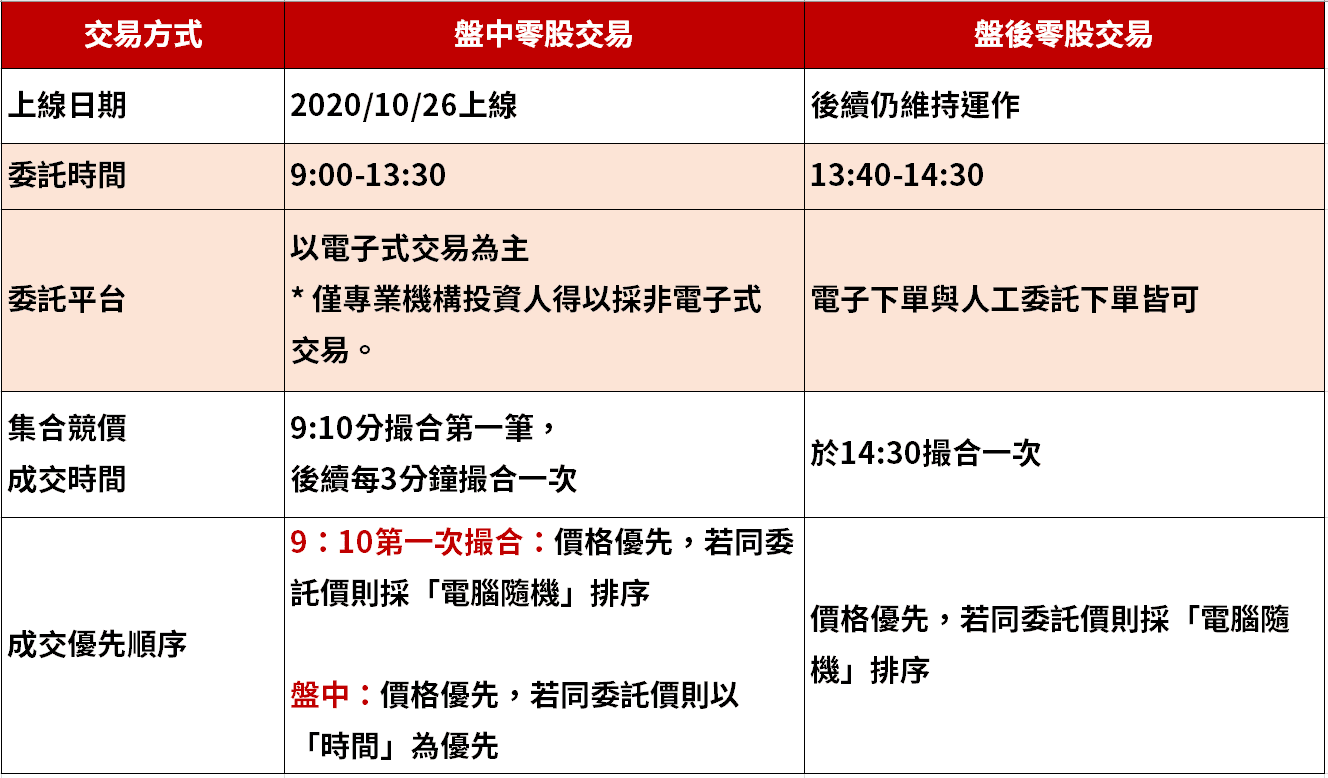



盤中零股 新制如何交易 3 張圖秒懂全新制度 豐雲學堂




电视 维基百科 自由的百科全书



H2的电子式怎么写




正宗美式皮卡new Ford Ranger職人型 全能型21年式全新到港 Taiwan Chinese Traditional 福特媒體中心




The All New Ford Kuga 21 5年式x 正式上市 Taiwan Chinese Traditional 福特媒體中心



Q Tbn And9gcqogakfnpsapnrj2zp2mbxukh6jedldvrojxqa M Vbywopgmzd Usqp Cau




高校化学基礎 電子式の書き方 映像授業のtry It トライイット




5分でわかる オクテット則 価電子のルールを理系ライターがわかりやすく解説 ページ 2 4 Study Z ドラゴン桜と学ぶwebマガジン




空氣清淨機知識問答




二重結合 三重結合の見分け方ってありますか 電子式を描く時に分からなすぎてボロボロで Clear




Ford Performance登峰造極之作 預接單破300張 創最狂接單佳績 歷代最強悍動力與絕對駕馭樂趣 售價136 8萬正式上市 Topcar Tw




二重結合ってどんな結合 科学館職員が5分でわかりやすく解説 Study Z ドラゴン桜と学ぶwebマガジン



Http Toitemita Sakura Ne Jp Kagaku Nyuumon Kouza 019 bunshi No Denshishiki kouzoushiki Pdf
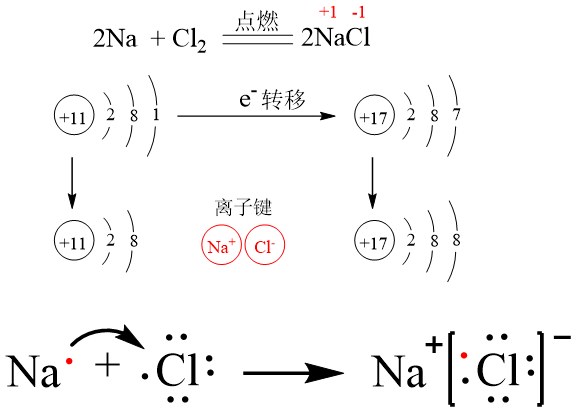



高中化学a14 化学键与分子间作用力 知乎




File Nitrogen Lewis Png Wikimedia Commons




アニメーション解説 共有結合とは 二酸化炭素などの例を図で完全解説 サイエンスストック 高校化学をアニメーションで理解する




高校化学 結合 三重結合 共有結合 オンライン無料塾 ターンナップ Youtube




この電子式で Cとnが三重結合するってどうやったらわかるんですか 暗記ですか Clear
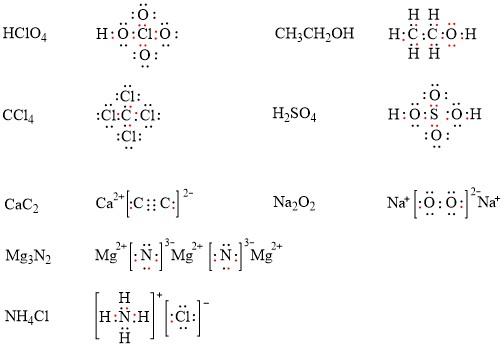



高中化学a14 化学键与分子间作用力 知乎



高中化学a14 化学键与分子间作用力 知乎




高等学校化学基礎 化学結合 Wikibooks




Bkhqgh Svm0ksm




電子式 電子対 不対電子 構造式 単結合 二重結合 三重結合 美味しいcoffeeを淹れる




電子式 Okedic



手機結合悠遊卡一嗶上車 悠遊付 App上線 主打五大實用功能 自由電子報3c科技




警專甲組超強金榜合輯 警專入學考 墊腳石購物網



Nの三重結合について 電子式の書き方はどちらが正しいですか Yahoo 知恵袋




电子技术在冰箱压缩机启动控制系统中的应用 冰箱 启动 电子技术 新浪科技 新浪网


コメント
コメントを投稿